光镊解开化疗药物对DNA的影响
康奈尔大学的新研究为常见化疗药物依托泊苷如何延缓和毒化使癌细胞蓬勃发展的必需酶提供了新的视角。
研究结果来自MichelleWang实验室,JamesGilbertWhite物理科学特聘教授和艺术与科学学院霍华德休斯医学研究所研究员,将推进一系列癌症抑制剂的研究。该小组开发的技术还将能够创建敏感的筛选工具,用于识别可以改善患者治疗的药物机制。
该小组的论文“EtoposidePromotesDNALoopTrappingandBarrierFormationbyTopoisomeraseII”于1月30日发表在NatureChemicalBiology上。共同主要作者是研究专家TungLe和博士后研究员MeilingWu。
40年来,依托泊苷一直是治疗多种癌症的值得信赖的化疗药物。依托泊苷通过靶向IIA型真核拓扑异构酶(也称为topoIIs)使癌细胞能够复制而取得成功。
复制过程的中心是长长的、缠绕在一起的螺旋状DNA链。为了使癌症扩散,这些链需要被运动蛋白解开、旋转和复制。TopoII非常适合这项工作。
他们表演了一种精心设计的绳索技巧,通过切割它来松弛超螺旋DNA,很快将另一条DNA链从它的中间穿过,然后将切割的DNA重新连接在一起。所有这一切都是在不破坏DNA脆弱的遗传结构的情况下完成的——这是一种令人难以置信、速度惊人的生物学壮举,每天在体内发生大约3000亿次。
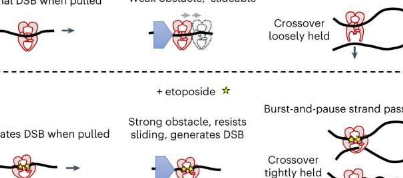
依托泊苷的一大优点是它可以在任何东西重新连接之前稳定DNA双链断裂,从而防止癌细胞复制。然而,依托泊苷如何与DNA结构相互作用的复杂性仍然不明朗。
“我们通常会问:研究发生在DNA上的分子机制的最佳方法是什么?”王说。“为了了解这些酶是如何工作的,我们想模拟细胞中可能发生的事情。运动蛋白拉动DNA或对DNA施加力。所以我们说,好吧,我们可以施加力,看看会发生什么。“
Wang的实验室使用三种不同的单分子操作技术来观察依托泊苷对三种由约翰霍普金斯大学JamesBerger教授领导的合作者提供的topoIIs的影响:酵母拓扑异构酶II、人类拓扑异构酶IIα和人类拓扑异构酶IIbeta。
“DNA拓扑结构,从概念上和扭转力学性能方面来说,人们真的很难掌握,”Wang说。“研究它的方法很少。但我们恰好拥有合适的工具。我们拥有合适工具的原因是因为在过去的20年里,我们一直致力于开发它们。这些工具和这个问题恰好在合适的时间汇合。”
首先,研究人员使用光镊将DNA拉伸成各种结构,展示了依托泊苷如何压缩、释放和打断它,并创建DNA环。这种环捕获行为让所有人都感到惊讶,因为它揭示了以前未知的依托泊苷的新影响。这意味着依托泊苷可以促进topoII在体内显着改变DNA结构和拓扑结构。
然后,该团队使用光学镊子将双链DNA解压缩为两条单链,以高分辨率绘制蛋白质与DNA相互作用的图谱,从而模拟了结合蛋白质的运动去除。研究结果表明,依托泊苷可以将topoII转化为DNA加工机制的强大障碍。
他们的第三种技术是一种磁性镊子,他们用结合的topoII扭曲DNA,并观察topoII以稳定的速度松弛DNA。当他们添加依托泊苷时,他们发现这种化学物质交错了这种模式,引入了与超螺旋环的捕获相关的停顿。
通过捕获依托泊苷增强这些作用和干扰拓扑II功能的不同方式,研究人员现在拥有一个定量系统来表征其他拓扑异构酶药物的行为方式。
“我认为这为我们提供了一套工具,使我们能够以非常全面的方式研究许多不同种类的拓扑异构酶和其他种类的药物,”Wang说。“我们所做的一切都模仿了体内发生的事情。我们只是以机械控制的方式进行。这就是它如此强大的原因。”
