基于DNA折纸的疫苗平台通过纳米级精确的分子间距增强抗肿瘤反应
治疗性癌症疫苗是一种正在开发中的免疫疗法,它不仅可以破坏患者体内的癌细胞,还可以防止癌症复发和扩散。多种治疗性癌症疫苗正在临床试验中进行研究,但尽管它们有希望,但临床肿瘤学家尚未常规使用它们来治疗患者。
治疗性癌症疫苗的核心成分是抗原,抗原是肿瘤细胞优先产生或新产生的(新抗原),使患者的免疫系统能够搜索并消灭癌细胞。
在大多数情况下,这些抗原不能单独发挥作用,需要佐剂分子的帮助,在称为抗原呈递细胞(APC)的免疫细胞中触发一般警报信号。APC内化抗原和佐剂分子,并将抗原呈递给不同类型的T细胞。然后,这些T细胞立即对肿瘤发起攻击,或者保留肿瘤的更持久的记忆以供将来防御。
癌症疫苗的有效性取决于其佐剂对APC发出“警报”的程度和持续时间。此前,研究人员发现,使用DNA折纸等纳米结构同时向APC递送佐剂和抗原分子可以增加APC的激活。然而,这些方法都没有系统地研究佐剂分子的数量和纳米级排列如何影响下游肿瘤定向免疫。
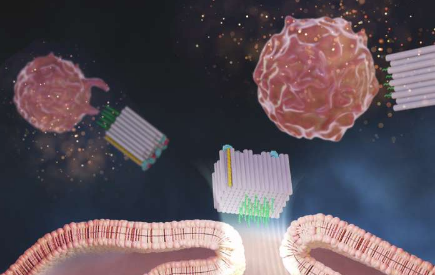
现在,哈佛大学维斯研究所、达纳法伯癌症研究所(DFCI)、哈佛医学院(HMS)和韩国科学技术研究院(KIST)的研究团队创建了一个名为DoriVac的DNA折纸平台,其核心组件是一种自组装的方形块状纳米结构。
在方形块的一个面上,可以以高度可调的纳米精度模式附着一定数量的佐剂分子,而另一面可以结合肿瘤抗原。研究发现,称为CpG的佐剂分子彼此之间的间隔恰好为3.5纳米,可对APC产生最有益的刺激,从而诱导出非常理想的T细胞特征,包括杀死癌细胞(细胞毒性T细胞)的细胞,那些引起有益炎症的细胞(Th-1极化T细胞)和那些提供肿瘤长期免疫记忆的细胞(记忆T细胞)。
DoriVac疫苗使荷瘤小鼠能够更好地控制肿瘤的生长,并且比对照小鼠的存活时间明显更长。重要的是,DoriVac的作用还与免疫检查点抑制剂的作用产生协同作用,免疫检查点抑制剂是一种非常成功的免疫疗法,已广泛应用于临床。研究结果发表在《自然·纳米技术》杂志上。
领导Wyss研究所团队的Wyss核心教员WilliamShih博士表示:“DoriVac的DNA折纸疫苗技术融合了我们多年来开发的不同纳米技术能力和对癌症抑制免疫过程的不断加深的了解。”与第一作者Yang(Claire)Zeng,MD,Ph.D.一起。
“我们设想,在未来,在不同类型肿瘤患者中鉴定出的抗原可以快速加载到预制的、含有佐剂的DNA折纸上,以实现高效的个性化癌症疫苗,可以与FDA批准的检查点抑制剂在联合疗法中搭配使用。”
Shih也是HMS和DFCI癌症生物学系的教授,并且与其他一些作者一样,是位于Wyss的跨机构“免疫工程以改善免疫治疗”(i3)中心的成员。
DNA折纸原理
CpG佐剂是由重复的CpG核苷酸基序组成的合成DNA链,可模仿免疫细胞入侵细菌和病毒病原体的遗传物质。与天然佐剂一样,CpG佐剂与免疫细胞中称为TLR9的“危险受体”结合,进而诱导炎症(先天)免疫反应,与抗原诱导的(适应性)免疫反应协同作用。
“我们从之前的工作中知道,为了引发强烈的炎症反应,TLR9受体需要二聚化并聚集成与多个CpG分子结合的多聚体复合物。结构分析揭示了有效TLR9组装体中CpG结合域之间的纳米级距离。我们假设的范围可以通过呈现精确间隔的CpG分子的DNA折纸结构来反映,”Zeng解释道,他在研究时是一名医学讲师,现在是DFCI和哈佛医学院(HMS)的高级科学家。
除了Shih之外,曾在该项目上还得到了资深作者、KIST首席研究员JuHeeRyu博士和Wyss创始核心教员、哈佛大学教授DavidMooney博士的指导。JohnA.Paulson工程与应用科学学院(SEAS)的教授,i3中心的首席研究员之一。
Zeng和团队制造了DoriVac疫苗,其中不同数量的CpG链在方形块的一个面上彼此间隔2.5、3.5、5或7纳米,并将模型抗原附着在另一面上。他们使用施团队早期开发的化学修饰方法来保护其结构免于在体内降解。
当被不同类型的APC(包括协调肿瘤定向T细胞反应的树突状细胞(DC))内化时,与由游离抗原分子组成的对照相比,DoriVac疫苗改善了抗原的摄取。
3.5纳米的CpG间距在APC中产生最强和最有益的反应,并且明显优于仅含有游离CpG分子的对照疫苗。
Zeng说:“我们很高兴地发现,DoriVac疫苗优先诱导支持抗肿瘤免疫的免疫激活状态,这正是研究人员通常希望在良好的疫苗中看到的。”
除了间距之外,DoriVac疫苗中CpG分子的数量也很重要。研究小组测试了含有12至63个最佳间隔CpG分子的疫苗,发现18个CpG分子提供了最佳的APC激活。这意味着他们的方法还可以帮助限制CpG分子的剂量,从而最大限度地减少佐剂常见的毒副作用。
获得(肿瘤)翻译
重要的是,这些体外趋势转化为体内小鼠肿瘤模型。当预防性地注射到小鼠皮下时,DoriVac疫苗在最近的淋巴结中积聚,并在那里刺激树突状细胞。
载有黑色素瘤抗原的疫苗可阻止随后注射的侵袭性黑色素瘤细胞的生长。虽然所有对照动物在实验第42天都死于癌症,但受DoriVac保护的动物都还活着。
DoriVac疫苗还抑制了已经形成黑色素瘤的小鼠体内的肿瘤生长,18个CpG分子的3.5纳米间距再次对DC和T细胞产生最大的影响,并最强地抑制肿瘤生长。
接下来,研究小组询问DoriVac疫苗是否也可以增强黑色素瘤中出现的小“新抗原”产生的免疫反应。
新抗原是理想的靶标,因为它们完全由肿瘤细胞产生。然而,它们本身通常不具有很强的免疫原性,这使得高效佐剂成为新抗原疫苗的重要组成部分。用四种新抗原定制的DoriVac疫苗使研究人员能够显着抑制产生新抗原的小鼠体内的肿瘤生长。
最后,研究人员询问DoriVac是否可以与免疫检查点疗法产生协同作用,免疫检查点疗法可以重新激活肿瘤中沉默的T细胞。
在小鼠中,两种疗法相结合导致黑色素瘤肿瘤完全消退,并在四个月后再次暴露于相同的肿瘤细胞时阻止它们重新生长。这些动物已经建立了肿瘤的免疫记忆。研究小组在小鼠淋巴瘤模型中获得了类似的疫苗接种效率。
Zeng说:“我们认为,DoriVac在确定佐剂递送的最佳点以及增强偶联抗原的递送和效果方面的价值可以为更有效的临床癌症疫苗用于患有多种癌症的患者铺平道路。”
该团队目前正在将DoriVac平台转化为临床应用,该研究得到了对小鼠体内疫苗分布和疫苗导向抗体以及体内免疫细胞响应疫苗产生的细胞因子的研究评估的支持。
“DoriVac平台是我们对分子机器人(具有可编程形状和功能的合成仿生分子)的追求如何带来全新且强大的治疗方法的第一个例子。这项技术为设计疫苗的开发开辟了一条全新的道路Wyss研究所创始主任DonaldIngber医学博士、博士说:“我们希望看到它能够快速转化为临床。”
