研究揭示了细菌防御系统组装过程中罕见的酶作用变化
科学家们揭示了蛋白质中一种前所未见的现象:这种酶单独处理 DNA 和 RNA,但当与另一种蛋白质结合作为防御系统的一部分时,它会与一种完全不同类型的化合物相互作用,帮助细菌自杀。
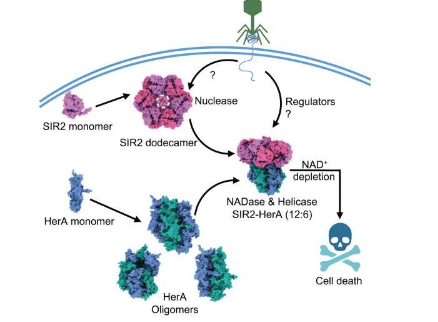
这一发现是在研究人员专注于详细说明这种防御机制如何在被噬菌体、侵入细菌细胞内并在细菌细胞内复制的病毒感染的细菌中发挥作用时得出的。除了详细说明蛋白质的结构和结合位点之外,实验还发现了酶功能的这种前所未有的转变。
“这是一个重大发现,”俄亥俄州立大学医学院生物化学和药理学助理教授、资深研究作者 Tianmin Fu 说。“当蛋白质形成复合物时,通常会增加或减少酶的活性,但我们从未见过功能上的完全转变。这对酶学领域来说是全新的。”
他说,从更大的角度来看,更好地了解细菌如何利用防御系统死亡而不是被噬菌体感染,可以转化为说服癌细胞也编程自己死亡的疗法。
“如果我们能够将这种类型的系统引入癌细胞,这可能会导致癌症治疗新策略的开发,”俄亥俄州立大学综合癌症中心的研究员 Fu 说。
该研究发表在《分子细胞》杂志上。
当被噬菌体感染时,细菌会选择死亡以防止噬菌体接管细菌群落。这项研究中检查的复合物,即称为 SIR2 和 HerA 的蛋白质组合,在之前专注于基因组分析的研究中与数百种其他细菌防御系统一起被鉴定出来。
在大肠杆菌模型中,Fu 及其同事使用冷冻电子显微镜来确定蛋白质单独以及在组装为超分子复合物期间和之后的生化结构。
“这个系统已经在许多不同的细菌中被发现,虽然我们在大肠杆菌中研究了它,但我们认为它在其他细菌中的功能非常相似,”傅说。
分析表明SIR2和HerA彼此具有亲和力,表明SIR2的轮状结构在两者形成由六个相同分子亚基组成的复合物之前充当HerA分子簇的组织者。然而,究竟是什么触发了它们的联系仍然是个谜。
结果表明,一旦组装完毕,该复合物就可以毫无意外地存在于细菌中,这表明细菌会以某种方式抑制系统的防御活动,除非噬菌体进入现场。当噬菌体被引入后,细菌很快就死亡了——这是它们自己的设计,因为防御系统被激活,耗尽了细菌生存所需的一种名为 NAD+ 的小分子。目前该激活机制仍然未知。
实验证实SIR2负责丢弃NAD+,这令人惊讶。SIR2 作为核酸酶的首要任务是消化核酸以维持正常的细胞功能。但当与 HerA 结合并作为防御系统的一部分被激活时,它的酶功能发生了转变——SIR2 变成了一种完全不同类型的酶,称为 NADase,它会产生基于水的反应来消散 NAD+。
“我们现在想要解决这个巨大的、基本的生物学问题——复杂的组装如何将 SIR2 的活性从核酸酶转换为 NADase?” 傅说。“弄清楚这一机制对于该领域来说意义重大,而且这个系统非常有趣,因为它在一个预组装的复合物中具有如此多不同的酶活性。”
傅还设想了未来的合成生物学工具箱,其中细菌技巧可以适应癌细胞杀死策略。“我们开始向细菌学习,希望我们能够将它们重新编程为癌症诊断和治疗的强大工具,”他说。
