金发姑娘效应研究人员建立蛋白质调控框架
从植物到动物,所有生物都依赖蛋白质来帮助其细胞正常运作。在某些情况下,例如当受到热或毒素的压力时,细胞内的一些蛋白质会凝结成液体状的液滴,称为冷凝物。
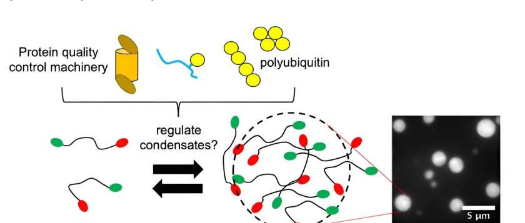
假设这个过程是通过相分离发生的,并为细胞组装某些组件提供了一种快速方法。雪城大学CarlosCastañeda教授实验室的研究最近表明,蛋白质质量控制(PQC)成分对于许多此类冷凝物非常重要。
卡斯塔涅达(Castañeda)是艺术与科学学院(A&S)的生物学和化学副教授,他是致力于了解蛋白质质量控制如何在细胞中发挥作用的研究团队之一。与计算机使用编码作为一组指令的方式类似,PQC从多聚泛素链接收指令。泛素(Ub)是一种存在于所有真核细胞(含有特定细胞核的细胞)中的调节蛋白,多聚泛素是至少含有一些泛素分子的组合体。
在正常操作条件下,冷凝物会形成并与压力源发生反应,然后在压力释放后溶解。但当这个系统遭到破坏时,可能会导致蛋白质聚集或聚集,从而导致细胞,尤其是神经系统中的细胞死亡。
这些异常的蛋白质聚集体是肌萎缩侧索硬化症(ALS)(也称为卢伽雷氏病)等神经系统疾病的标志物。通过了解导致PQC失调的情况,科学家们希望这项研究有一天能够治愈此类神经退行性疾病。
在去年发表在EMBOReports上的一篇论文中,Castañeda和他的合作者建立了一个框架,用于说明多聚泛素链如何调节由Ubiquilin-2(UBQLN2)蛋白组成的冷凝物的形成和分解,该蛋白的失调与ALS有关。
多聚泛素对于UBQLN2功能很重要,两者以非共价键结合,这意味着它们之间的相互作用弱于共价化学键。继这项工作之后,研究人员希望进一步探索影响这些冷凝物组装的具体条件。
“在开展EMBO报告项目时,我们开始发现更多延伸的多聚泛素链有利于与UBQLN2发生相分离(冷凝物形成),”Castañeda说。“所以,我们想知道这是否总是正确的。我们决定制作更长的链条。”
通过本科生研究体验(REU)计划,卡斯塔涅达于2021年欢迎学生SuzanneEnos和AntaraChaudhuri来到他的实验室。这个由NSF赞助的REU计划将全国各地的本科生带到雪城大学校园,在夏季参与研究。
在Castañeda的实验室中,该团队工程和设计了不同类型的具有可变长度和拓扑的多聚泛素链。Enos和Chaudhuri随后帮助测试了这些链与UBQLN2的相分离效果。
经过Castañeda实验室前博士后研究员SarasiGalgedera的进一步设计工作;ThuyDao,化学系实验室经理;和堪萨斯州立大学物理学教授JeremySchmit一起,研究小组发现存在一个“最佳点”,即Ub单元之间的特定间距,可以优化凝结水的形成。该小组的研究结果最近发表在《美国国家科学院院刊》上,被恰如其分地称为“金发姑娘”。
Castañeda说:“我们发现多聚泛素中的泛素单元的排列对于缩合物的形成来说‘恰到好处’。”“距离太远或太近的泛素单元不太有利于凝聚态的形成。杰里米·施密特使用理论模型和多相连接概念来概括这些实验观察结果。”
此外,他们发现过量的多聚泛素会导致缩合物分解。“在细胞中,你可以想象多聚泛素的浓度,以及不同类型多聚泛素内泛素单元之间的间距,可以上调或下调凝结物的形成。本质上,你有多种方法来调节凝结物的形成,只需添加这个一种多聚泛素分子,”Castañeda指出。
虽然他们的研究仅仅触及了多聚泛素链如何调节冷凝物相分离的表面,但卡斯塔涅达表示,它提供了证据,证明这些链将成为液滴的主要调节剂。未来的研究将涉及使他们的规则适应模拟PQC的体外系统,以在活细胞中证明和测试他们的理论。
Castañeda说:“这项工作提供了一个原理,可用于理解生物分子凝聚体的一般控制方式,并且对于任何研究他们最喜欢的生物分子凝聚体的调节的人都将产生重大影响。”
