DNA修复机制的关键线索可能会带来新的癌症治疗方法
东京都立大学的研究人员已经确定了我们体内 DNA 修复机制的关键因素。他们首次表明,DNA 复制酶聚合酶 epsilon 的“校对”部分确保了 DNA 链受损部分复制的安全终止,最终使 DNA 免遭严重损坏。这些新知识为科学家提供了使抗癌药物更有效的方法,并可能提供新的诊断方法。
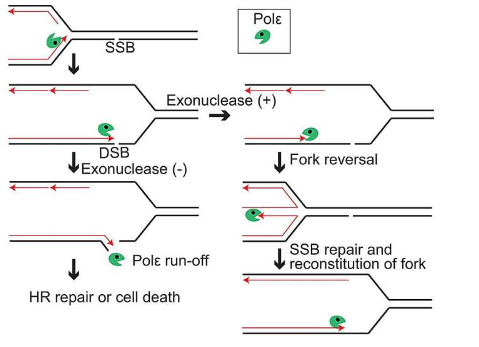
我们的 DNA 正受到攻击。每天,单个细胞中构成 DNA 螺旋的链中会出现约 55,000 个单链断裂 (SSB) 。当聚合酶(复制 DNA 链的分子)尝试从断裂的链中制造新的螺旋时,它们会破坏螺旋,从而产生所谓的单端双链断裂 (seDSB)。
值得庆幸的是,细胞有自己的方式来处理链损伤。一种是同源定向修复(HDR),修复双链断裂。另一种是“分叉逆转”,即复制过程被逆转,从而防止单链切口首先转变为 DSB。
分叉反转背后的确切机制仍然未知。了解如何预防 DNA 损伤不仅对于预防癌症至关重要,而且对于确保依赖 DNA 损伤的抗癌药物的有效性至关重要。以喜树碱 (CPT) 为例,这是一种会产生大量单链断裂的抗癌药物;由于癌细胞往往复制得更快,它们会产生大量 seDSB 并死亡,从而使正常细胞受到的伤害较小。
现在,由东京都立大学 Kouji Hirata 教授领导的国际团队对叉反转的工作原理有了新的认识。他们专注于聚合酶 epsilon,这是一种负责从已解压的 DNA 部分制造新 DNA 的酶。他们发现核酸外切酶(聚合酶中确保复制准确性的“校对”部分)发挥了关键作用,这是对叉反转背后很大程度上未知的分子机制的新的、罕见的见解。
该论文发表在《核酸研究》杂志上。
首先,研究小组发现,核酸外切酶部分缺陷的细胞对暴露于 CPT 表现出强烈的敏感性。抑制 PARP(唯一已知影响分叉逆转的因素)也会导致细胞死亡增加。然而,当两者都被抑制时,细胞死亡没有进一步增加,超过了 PARP 所观察到的情况。这表明 PARP 和聚合酶 ε 核酸外切酶共同作用以触发叉逆转。
此外,研究小组还研究了编码 BRCA1(乳腺癌易感蛋白)的基因被破坏的细胞。核酸外切酶的额外缺陷导致对 CPT 的敏感性急剧增加,远远超过任一缺陷的预期。由于 BRCA1 缺陷与乳腺癌的高风险有关,因此外切核酸酶可能会被靶向以使药物治疗更有效。
研究人员表明,针对聚合酶ε核酸外切酶的药物可以增强抗癌药物的效果。同样重要的是,核酸外切酶的缺陷也已在多种癌症中发现,包括肠癌;这使得这些细胞的叉逆转能力可能受损,而叉逆转能力是未来诊断和治疗的一个有希望的目标。
