新方法提供了对蛋白质蛋白质相互作用的分子洞察
蛋白质是我们身体的组成部分,但它们不能单独发挥作用。他们组成合作伙伴来促进不同的生物过程,使我们继续前进。然而,分析蛋白质如何在分子水平上相互作用可能具有挑战性。现在,来自日本的一个研究小组揭示了这些“蛋白质伙伴关系”背后的秘密。
在最近发表在《蛋白质科学》上的一项研究中,东京医科齿科大学(TMDU)的研究人员开发了一种新方法,通过结合两种技术来识别两个蛋白质分子上的相互作用位点。
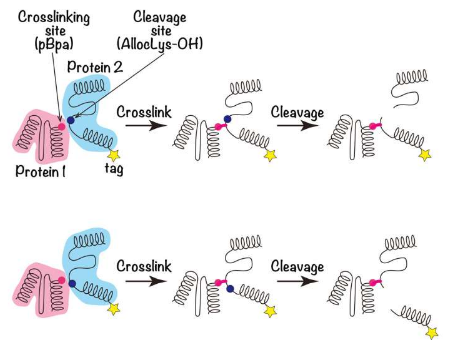
蛋白质由称为氨基酸的分子链组成,然后形成三维结构。一种称为pBpa的氨基酸天然不会出现在蛋白质的其他任何地方,可以使用遗传密码扩展(GCE)将其引入到感兴趣的蛋白质中。
然后,光照射将导致两个相互作用的蛋白质交联并粘在一起。然而,虽然pBpa插入的位点已知,但缩小第二种蛋白质上的相互作用区域的范围非常困难。
为了解决这个问题,该团队使用GCE在第二个蛋白质的已知位置引入了一个切割位点“AllocLys-OH”。第一作者KazueTerasawa解释说:“在该位点切割交联蛋白可以提供有关结合界面位于AllocLys-OH位点哪一侧的信息。”
“每种蛋白质的一端都以可检测的方式标记。如果切割实验将这些标签分开,那么切割位点比交联相互作用位点更接近蛋白质的标记末端。”通过在不同位置的AllocLys-OH切割位点进行一系列这些实验,可以缩小第二种蛋白质上结合界面的位置。
他们通过检查一种名为LAMP2A的蛋白质的结合位点来验证这项技术。它是溶酶体细胞结构周围膜的主要成分,也是伴侣介导的自噬过程的受体,该过程是分解细胞内蛋白质作为正常细胞功能的一部分的关键。已知LAMP2A的各个分子以亲同性相互作用结合在一起,但这种相互作用的细节尚不完全清楚。
“经过一系列的交联和裂解实验,我们能够阐明LAMP2A同亲相互作用的几何结构。根据蛋白质已知的三维结构,我们发现的相互作用位点的位置表明LAMP2A必须形成三聚体,或者更高的寡聚结构,”资深作者MikiHara-Yokoyama解释道。
这种新方法对于研究蛋白质-蛋白质相互作用的研究人员来说是一个重大突破。它可以表征蛋白质结合界面,揭示复杂的蛋白质几何形状。它也适用于所有哺乳动物细胞,因此,它可能可用于治疗应用。
