CryoEM研究表明锌转运蛋白具有内置的自我调节传感器
美国能源部(DOE)布鲁克海文国家实验室的科学家们已经确定了锌转运蛋白的原子级结构,锌转运蛋白是一种调节细胞内这种关键微量金属微量营养素水平的分子机器。正如刚刚发表在NatureCommunications上的一篇论文所述,该结构揭示了细胞膜蛋白如何改变其形状以将锌从环境中转移到细胞中,并在细胞内的锌水平过高时自动暂时阻止这一行动。
“锌对许多生物活动都很重要,但过多可能会成为一个问题,”领导该项目的布鲁克海文实验室生物物理学家QunLiu说。“在进化过程中,不同的生物体以多种方式进化来调节锌。但是没有人证明控制从环境中吸收锌的转运蛋白可以调节其自身的活动。我们的研究是第一个展示锌转运蛋白的研究内置传感器。”
该研究是作为布鲁克海文实验室定量植物科学计划(QPSI)的一部分进行的。使用与植物中的锌转运蛋白具有相同基本特征的锌转运蛋白的细菌版本,科学家们获得了对这些蛋白质如何工作的重要见解。
“这项研究是我们努力了解植物如何吸收锌等微量营养素的一部分,因此我们可以了解如何设计能够更好地在边际土地上生长以生产生物能源的植物,”布鲁克海文实验室生物学系主任约翰说。Shanklin,该论文的合著者。
科学家们指出,这项研究还可以提出设计粮食作物以提高锌含量以提高其营养价值的方法。
Cryo-EM加计算
为了解析蛋白质结构,Brookhaven团队在生物分子结构实验室(LBMS)使用冷冻电子显微镜(cryo-EM)。通过这种技术,科学家们可以对蛋白质的许多不同构象进行采样,而不是对单一的结晶形式进行采样。这很重要,因为在自然界中,蛋白质是动态的,而不是静态的;它们的碎片四处移动。
“Cryo-EM不需要蛋白质来形成晶体,因此我们实际上可以捕获使用X射线晶体学可能无法实现的动态步骤,这是另一种研究蛋白质结构的技术,”刘说。“本质上,使用冷冻电镜,我们可以捕获更多‘电影’的帧,从而获得一种非常有助于理解蛋白质生物学功能的结构。”
为了对结构的众多变化进行分类,科学家们需要强大的计算工具。其中包括使用机器学习的人工智能方法,其中一些是Liu开发的。使用这些算法,科学家们可以半自动地选择和分类数百万张冷冻电镜图像,以找到具有相似性的结构组。该方法使他们能够实现最高的可行分辨率,从而揭示结构的原子级细节。
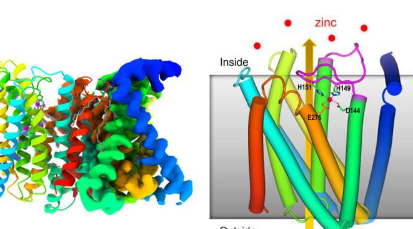
在这项研究中,这种低温电子显微镜方法揭示了ZIP(Zrt-/Irt样蛋白)锌转运体一个阶段的关键特征,揭示了它如何根据细胞中已有的锌量调节自身的锌摄取活动.
“我们的新数据使我们修正了之前关于这种蛋白质如何工作的观点,”刘说。
倾斜进入,感应停止
一份基于X射线晶体学和协同进化分析的早期报告表明,转运蛋白可能起到一种“电梯”的作用来转运锌。这项新研究表明,与细胞膜两侧锌的相互作用如何触发蛋白质部分的运动,从而将锌带入细胞——而且至关重要的是,当细胞内的水平过高时,会阻止其进入。
“我们的关键结构表明,当细胞内的锌水平上升到一定水平时-超出满足细胞需求所需的水平-过量的锌与膜内部的环结合,”刘说。“然后,当这个柔性环重新定向时,它会自行折叠,并以阻止锌进入细胞的方式结合。”
“这几乎就像塞子插入浴缸的排水管并堵塞它一样,”尚克林补充道。
科学家们还研究了蛋白质的其他部分如何移动以允许锌进入。
当电池内的锌含量较低时,锌会从环状部分脱落,插头会从转运器中弹回。环境中的锌可以进入转运体。在转运器内部,锌导致蛋白质机器的一部分向上移动并倾斜,从而关闭与外部环境的出口。一旦锌进入电池,机器就会重新开始工作。
“我们的低温EM结构首次展示了蛋白质的这个环结构域如何根据锌的水平通过反馈调节转运蛋白的活性,”刘说。
它也是第一个表明这种锌转运蛋白是两种相同蛋白质(称为二聚体)排列的结构。“它需要两个分子来完成这项工作,”刘说。
科学家们认为,两个分子以二聚体的形式起作用可能与其功能或稳定性有关——他们将通过未来的分子如何协同工作的计算模拟来探索这一点。
“这项研究可以为微生物和植物中的锌转运蛋白设计新方法,以优化它们在锌含量过低或过高的条件下的生长,可能在生产生物能源和生物产品的边际土地上,”刘说。
