生化状态和力协同作用的新证据
在爬行细胞的前缘内,错综复杂的杆状肌动蛋白丝网络以不同的角度向细胞膜延伸,逐个延长蛋白质。撞击时,纵横交错的杆从膜上掠过并弯曲,因为无数细丝的集体力将细胞向前推动。
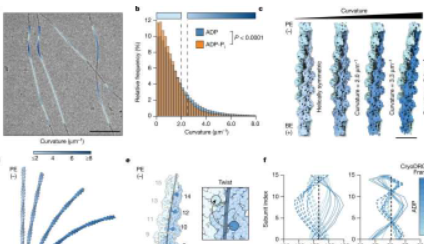
这些细丝有多灵活,以及它们如何有效地招募必需的调节蛋白来发挥作用,取决于组成它们的各个肌动蛋白的特性。现在,《自然》杂志上的一项新研究提供了高分辨率结构,显示了肌动蛋白的两种关键生化状态如何与弯曲力共同作用,以确定肌动蛋白如何与其他蛋白质相互作用。
洛克菲勒的GregoryAlushin说:“当你在混合中增加力量时,你会看到巨大的变化。”“我们提供了明确的证据,表明肌动蛋白的这些生化变化只能通过细丝的机械特性来读取。”
重新审视蛋白质控制
肌动蛋白丝是肌动蛋白的长聚合物,首尾相连。细丝内的肌动蛋白可以以两种重要的生化状态之一存在。新添加到聚合物中的肌动蛋白含有磷酸盐分子,而老化的肌动蛋白则不含;否则,这两个状态或多或少是相同的。但是肌动蛋白结合蛋白可以区分它们,它们会根据肌动蛋白的状态结合或忽略细丝。
肌动蛋白结合蛋白如何区分这些状态是一个长期存在的谜团。一些人提出磷酸盐以某种方式改变了肌动蛋白的形状,使肌动蛋白结合蛋白在体内从人群中挑选出来。事实上,当其他分子锁定它们时,许多酶可以在形状之间转换,这一过程称为变构调节。假设肌动蛋白没有什么不同是有道理的。
但在不知道肌动蛋白的两种生化状态究竟是什么样子的情况下,这只是一种猜测。Alushin想知道这个故事是否还有更多内容。“如何控制蛋白质是一个古老的问题,”他说。“已经有一段时间没有探索新的想法了。”
方法论的飞跃
Alushin实验室的研究生MatthewReynolds开始研究每个州的高分辨率结构。在检查这些结构后,结合的磷酸盐和水分子被清楚地分辨出来,研究小组发现这两种肌动蛋白状态仍然无法有效区分。
无论肌动蛋白是否与磷酸盐结合,这些结构都具有几乎相同的细丝晶格和蛋白质骨架。如果涉及标准变构调节,肌动蛋白与磷酸盐结合时会发生显着变化——调节蛋白可以用来区分一种肌动蛋白与另一种肌动蛋白的主要差异。但是观察到的差异对于肌动蛋白结合蛋白来说似乎太小了,无法区分它们。
为了寻找替代解释,该团队开发了一种机器学习方法,在他们的低温电子显微镜图像中找到相对较少数量的弯曲细丝,以分析它们的结构。然后,他们确定了两种生化状态下弯曲细丝的结构,其中当细丝在运动过程中从膜上掠过时,弯曲程度与细胞中的弯曲程度相匹配。
“开发一种捕获这些图像子集的方法至关重要,”Alushin说。“这是一个科学进步需要方法论进步的案例。”
当弯曲时,含有磷酸盐的肌动蛋白看起来与不含磷酸盐的肌动蛋白非常不同,因此肌动蛋白结合蛋白将能够轻松区分这两种状态。
“灯丝生化状态的变化会影响灯丝在施加力时变形的方式,”雷诺兹说。
一种新的模型开始出现:虽然细丝中的肌动蛋白可以在聚合物弯曲时以多种方式弯曲,但当磷酸盐限制其样式时,这种柔韧性会受到限制。想象一个并排的包含小甜甜圈的柔性管。有些甜甜圈有空洞,有些甜甜圈的洞里有高尔夫球,但它们在其他方面是相同的。当管子弯曲时,甜甜圈都会压扁并改变形状,但那些有高尔夫球的甜甜圈会变形。
同样,肌动蛋白的两种状态在细丝弯曲之前基本上无法区分,但是一旦施加力,磷酸盐的挤压与没有磷酸盐的挤压不同。“重要的是蛋白质的可变形性,”Alushin说。“如果中间有一个洞,它可以以一种方式弯曲。如果你用磷酸盐填充那个洞,它就不能以同样的方式挤压。”
结果解释了肌动蛋白结合蛋白如何区分肌动蛋白的生化状态,并揭示了一种涉及生化状态和力协同工作的蛋白质调节模型。在未来的研究中,Alushin希望研究其他蛋白质是否也有类似的共同调节。
“我们对肌动蛋白的研究是对这一现象的第一次了解,但目前的一个限制是我们没有其他力响应蛋白的结构在起作用,”他说。“研究这些蛋白质是值得的,因为它在技术上变得可行。”
