对病毒出芽的结构洞察揭示了致命疾病的潜在目标
由拉霍亚免疫学研究所(LJI)和普渡大学领导的团队领导的科学家们发表了一项研究结果,他们声称这是首次对麻疹和尼帕病毒这两种副粘病毒生命周期的关键阶段进行观察。研究结果为病毒复制提供了新的见解,有助于为未来的药物发现工作提供信息。
“这项工作解决了一个长期存在的谜团:病毒如何自我组装,”LJI教授EricaOllmannSaphire博士说,她与普渡大学RobertStahelin教授共同担任该研究的共同高级作者。“我们知道病毒的许多部分在细胞膜上聚集在一起,但我们不知道启动不可逆组装过程的触发器是什么。”Stahelin补充道:“这项研究成功地确定了副粘病毒如何利用宿主细胞脂质进行病毒传播。这项工作将为未来的药物发现工作提供信息。”
Saphire、Stahelin及其同事在《科学进展》上发表了一篇题为“麻疹和尼帕病毒组装:特异性脂质结合驱动基质聚合”的论文,报告了他们的发现。
副粘病毒家族包括麻疹病毒和尼帕病毒,以及腮腺炎、新城疫和犬瘟热。研究人员认为,该病毒家族有可能引发毁灭性的大流行。他们写道:“副粘病毒对人类和动物健康构成重大风险,继续关注病毒复制周期内的新目标至关重要。”
第一作者、LJI前博士后、现任多伦多大学助理教授迈克尔·诺里斯(MichaelNorris)博士补充道:“麻疹的传染性是任何已知病毒都无法比拟的。如果一名麻疹患者在一间有100名未接种疫苗的人的房间里咳嗽,大约90人就会被感染。尼帕病毒的传染性不那么强,但致命性极高,40%至90%的感染会导致死亡。想象一下,如果出现一种像麻疹一样具有传染性、像尼帕病毒一样致命的副粘病毒。”
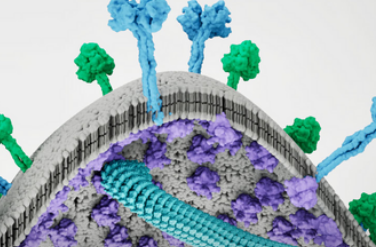
该团队的新研究结果揭示了未来的疗法如何阻止这些病毒的传播。在他们的工作中,研究人员使用了多种成像技术,包括X射线晶体学和电子显微镜,来捕获病毒组装。在病毒组装过程中,关键蛋白质和遗传物质被招募到受感染宿主细胞膜上的特定区域。病毒基质(M)蛋白聚集在一起,在细胞膜内部形成晶格。这些基质蛋白是病毒组装过程的驱动因素。诺里斯称它们为“元帅”,负责收集和引导形成新病毒所需的其他蛋白质。基质蛋白也赋予病毒形状。
随着病毒组装的继续,基质蛋白的晶格开始将膜向外推动形成“芽”,并将其他病毒蛋白招募到该位点。一旦芽具备了所有所需的成分,它就会从母细胞中分裂出来,形成一种新的病毒,然后可以感染新的宿主细胞。
研究人员希望通过更好地了解病毒组装,他们可以设计出中断该过程的疗法。这种方法很有希望。药物Lenacapavir针对HIV的组装过程,目前正在进行临床试验,诺里斯表示有可能使用相同的策略来阻止副粘病毒。“这种艾滋病毒疗法证明了靶向病毒组装是药物开发的可行策略,”他说。
科学家只需要清楚地了解副粘病毒组装过程。研究人员面临的挑战是试图观察基质蛋白的作用。正如作者指出的,“副粘病毒从受感染细胞的质膜(PM)中出芽。病毒基质(M)蛋白通过排列其他病毒结构成分(包括表面糖蛋白和沿宿主PM组装位点的病毒复制复合物)来协调新病毒体的出芽……然而,M蛋白与膜结合的性质,导致病毒组装主要发生在PM的作用、触发病毒基质聚合的因素,以及M与脂质膜的单独相互作用是否足以在PM中形成向外的突起,目前仍不清楚。”
诺里斯和他的同事检查了麻疹病毒和尼帕病毒的病毒组装。结果表明,两种基质蛋白如何以一种拥抱的方式结合在一起,形成双边“二聚体”结构。研究人员证明,阻断这种二聚体的形成也能阻止病毒组装。这并不奇怪,研究人员真正需要知道的是这些二聚体在萌芽过程中如何与其他结构相互作用。他们的研究表明,二聚体拥抱漂浮到细胞膜内部,与细胞膜碰撞。
在普渡大学Stahelin实验室牵头的工作中,研究小组发现基质蛋白与宿主细胞膜中称为磷脂酰肌醇4,5-二磷酸[PI(4,5)P2]的脂质分子特异性结合。这种相互作用将基质蛋白锚定到宿主细胞膜表面,并为病毒在膜上特定位点的组装提供交汇点。Norris和他的同事使用X射线晶体学详细捕捉到了这种相互作用。
然后出现了一个巨大的结构性惊喜。研究小组发现,尼帕病毒基质蛋白实际上改变了其结构,从而打开了PI(4,5)P2的脂质结合袋。“这是这项研究中非常令人兴奋的一个方面,”诺里斯说。他强调,这个口袋在膜结合之前并不存在,如果没有本研究中捕获的结构,就不会发现这个口袋。口袋的发现揭示了开发组装过程抑制剂的新潜在目标。
PI(4,5)P2也被证明是触发基质蛋白二聚体相互结合以在宿主细胞膜内表面形成晶格的秘密成分。当基质蛋白改变其结构以打开PI(4,5)P2口袋时,它们也会采用驱动晶格组装的形状。
基质蛋白结构的这种变化会使细胞膜弯曲。在PI(4,5)P2结合之前,拥抱的两个基质蛋白之间的空间具有带有倾斜侧面的凹碗形状。PI(4,5)P2之后与基质蛋白结合后,这些有角度的侧面变平,将碗形转变为板形,并迫使膜向上弯曲。然后细胞膜的柔软曲线弹出,开始形成新的芽,最终形成新的病毒。科学家们从这些结构中学到了很多东西。“我们不知道当这个过程被触发时,分子会发生多少变化,也不知道当它们聚集在一起时,结构会是什么样子,”萨菲尔指出。该团队总结道:“利用X射线晶体学、电子显微镜和分子动力学,我们证明PI(4,5)P2结合会诱导M蛋白表面的构象和静电变化,从而触发膜变形、基质层聚合和病毒体组装。”
麻疹仍然是世界各地的主要杀手。印度和孟加拉国每年都会应对尼帕疫情的爆发。这些病毒不会消失,需要有效的治疗方法来阻止疫情的爆发。广泛的副粘病毒疗法还可以保护牲畜免受疾病并确保粮食安全。家禽新城疫是由副粘病毒感染引起的,在症状出现之前就可以消灭整个鸡群。2018年至2020年,加州爆发新城疫,导致120万只家禽被扑杀。
这项新研究显示了针对多种病毒中病毒组装的泛副粘病毒疗法的潜力。诺里斯指出,虽然麻疹病毒和尼帕病毒的基因组非常不同,但麻疹病毒和尼帕病毒的基质蛋白看起来几乎相同。
诺里斯说:“由于这些基质蛋白结构高度保守,我们可能会针对一种病毒,并有一种抑制剂可以针对该家族中的所有其他病毒。”作者在论文中进一步写道,“虽然未来的研究需要确定M蛋白、脂质和宿主蛋白如何协同工作形成病毒粒子,但阐明M的结构和膜相互作用可以解释它们如何指导病毒粒子形成,并将提供3D模型。”用于设计抑制副粘病毒组装和流出的药物的模板。”
得益于LJI的Tullie和RickeyFamiliesSPARK免疫学创新奖的资助,Norris能够开始寻找基质蛋白抑制剂。这笔资金使他能够迅速缩小超过740万种候选药物的范围,以确定大约100种将进行进一步测试。
下一步是更好地了解构成基质晶格的分子相互作用,并更好地了解基质蛋白在组装过程中如何招募其他病毒蛋白并与之相互作用。“我们正在考虑利用这项工作来设计病毒组装的广谱抑制剂,”诺里斯说。该团队在论文中得出结论:“……针对副粘病毒M蛋白上保守的PI(4,5)P2结合位点的小分子抑制剂的结构引导开发对于开发针对副粘病毒感染的广谱抗病毒药物非常重要”。
