科学家开发出设计蛋白质复合物中人工变构位点的策略
根据一组科学家最近发表的一篇研究论文,已经开发出一种突破性的方法来在蛋白质复合物中创建人工变构位点(通过结合效应分子,调节远端活性位点的活性)。这项突破性研究为工业、生物、医学和农业领域的广泛应用带来了重大前景。
该团队的研究成果于2023年7月6日16:00(伦敦时间)发表在《Nature Chemistry 》上
蛋白质复合物,例如血红蛋白和分子马达,通过亚基(蛋白质复合物中的组成蛋白质)之间的协作发挥协同作用。这种编排是通过变构机制实现的。变构效应,即通过效应分子与另一个亚基中的变构位点结合来调节亚基中活性位点的功能,最初于 20 世纪 60 年代提出,从那时起它一直是生物化学领域最重要的主题之一。研究小组开发了一种策略,将人工变构位点设计到蛋白质复合物中,以调节蛋白质复合物的协同功能。“在蛋白质复合物中创建人工变构位点有可能揭示变构的基本原理并作为合成生物学的工具,
研究小组假设,蛋白质复合物中的变构位点可以通过恢复假活性位点的丢失功能来创建,这些假活性位点预计在进化过程中已经丢失。各种蛋白质复合物包括具有假活性位点的亚基。据报道,假活性位点与其他亚基中的活性位点具有变构连接。例如,亚基中的假活性位点已失去 ATP 酶活性,但仍表现出 ATP 结合能力,在与 ATP 结合后激活另一个亚基的活性位点。(在细胞水平上,ATP 是能量的来源。ATP 酶描述了酶分解 ATP 的能力。)此类研究支持这样的观点:通过设计假活性位点,可以在蛋白质复合物中创建不同的变构位点。
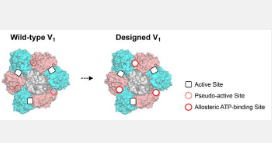
研究小组利用计算设计来恢复旋转分子马达 V 1 -ATPase的 B 亚基中假活性位点失去的 ATP 结合能力(图 1)。首先,通过 X 射线晶体学实验揭示了设计位点的结合能力。“X射线结构表明结合位点已成功设计并整合到天然蛋白质中以发挥功能。我对蛋白质设计技术的高性能的实用性感到惊讶。” 材料结构科学研究所副教授田边干雄说道。接下来,他们的 X 射线晶体学分析单分子实验表明,ATP 与设计的变构位点的结合增强了 V 1与野生型相比,其活性较高,并且可以通过调节 ATP 的结合亲和力来调整旋转速率。该团队在旋转电机中创造了协作性。此外,与野生型相比,该团队设计的变构加速了而非减速了旋转(图2)。“据我们所知,通过蛋白质工程加速旋转分子马达是首次取得成就。这是该领域令人兴奋的结果。” 日本国立自然科学研究所教授饭野亮太 (Ryota Iino) 说道。
假活性位点在自然界中广泛存在,它们的方法有望成为对蛋白质复合物协同功能进行变构控制的一种手段。此外,蛋白质设计方法不仅能够恢复失去的功能,还能设计其他配体的结合位点。“原则上,我们的策略使我们能够在各种蛋白质复合物中创建变构位点。我们的下一步是通过我们的策略为各种蛋白质复合物创建变构控制。此外,我们将尝试在伪活动站点中设计新颖的功能。我们的目标之一是人为控制任何蛋白质复合物的协同功能并揭示变构的一般机制。
研究团队包括来自国立自然科学研究所 (NINS) 分子科学研究所 (IMS)、NINS 生命和生命系统探索研究中心 (ExCELLS)、SOKENDAI(高级研究大学)和 PRESTO 的 Takahiro Kosugi日本科学技术振兴机构;来自 IMS NINS 和 SOKENDAI 的 Tatsuya Iida 和 Ryota Iino;Mikio Tanabe,来自高能加速器研究组织(KEK)材料结构科学研究所;和来自 IMS NINS、ExCELLS NINS、SOKENDAI 和大阪大学的 Nobuyasu Koga。
